小编语
在新药法下,越来越多配套文件发布实施,本公司注册人员就附条件批准对境内境外未上市的新药研发注册策略进行了总结归纳,汇集成文与同行分享,如有错误还请批评指点。

上周四CDE发布了《药品附条件批准上市技术指导原则(试行)》的通告,自发布之日起施行。附条件批准上市程序是今年的一大亮点,自《药品注册管理办法》颁布之日起受到业界的高度关注。传闻不用临床就能上市?申请在手,批文在手?这到底是什么神仙政策?如今其配套文件发布下来,我们一起来看看这大葫芦里面到底卖的是什么药。
首先开通附条件路径的目的主要是为了让无法等待的严重患者或公共卫生方面急需的患者尽早地用药。其路径的前提条件有两个:
1、治疗严重危及生命且尚无有效治疗手段的疾病以及公共卫生方面急需的药品,药物临床试验已有数据显示疗效并能预测其临床价值的;
2、应对重大突发公共卫生事件急需的疫苗或者国家卫生健康委员会认定急需的其他疫苗,经评估获益大于风险的。
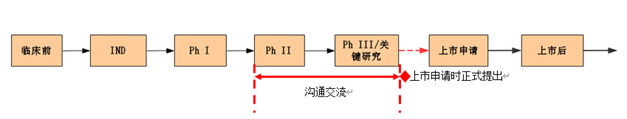
附条件路径应用在临床期的加速,申请人在临床II期和临床III期间申请沟通交流会议,与CDE讨论,pre-NAD时与CDE初步确认。
根据原文“通常,附条件批准上市药品的药学、药理毒理学要求与常规批准上市药品相同。鉴于附条件批准上市药品尚未满足常规上市注册的全部要求,因此申请人应与药品审评中心就上市后承诺完成的研究等内容共同讨论并达成共识。应至少包括如下内容:上市后临床研究计划、研究完成日期、最终临床研究报告提交日期以及上市后风险管理计划等,申请人应承诺按时完成所有的临床试验”可以知道,想附条件上市,所做的试验一个都不能少,包括临床前研究与临床研究(早期临床和关键临床)。简单来说,附条件批准就是先批准,后确证,再通过。不能证明获益大于风险的,注销药品证书。说好的附条件,怎么会给你吃霸王餐?无非就是给有缘人激活白条,今日激活,自动上市,“随心”分期。施主,出来混迟早要还的。指导原则助力下,新型冠状病毒预防用疫苗百花齐放的春天还远吗?虽然现在疫情略有回升,但在国家的大力支持下,一线人员的无私奉献下,企业深入细致的研究下,抗击疫情斗争一定会得到全面胜利。
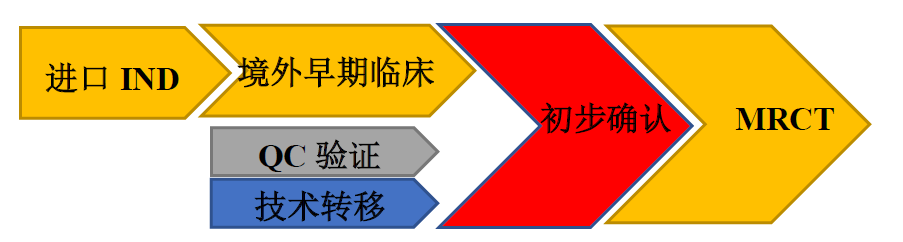
药品加快上市注册程序的上台既与国际化接轨,贯彻“放管服”的重要思想,也体现了以临床价值为导向的药物研发。企业应该着重于以终为始的决策树思想,以临床价值为始点,在立项之初考虑品种是否能纳入加快上市注册路径作为临床开发和注册策略的一部分,把握申请的关键程序和关键节点。同时也要关注同类品种的开发和注册状态,评估对本企业药物的影响,从而调整策略。以下是小编个人就附条件批准在境内境外新药研发策略中的关键程序归纳。初步确认为附条件批准申请关键节点。
01境内自主研发策略
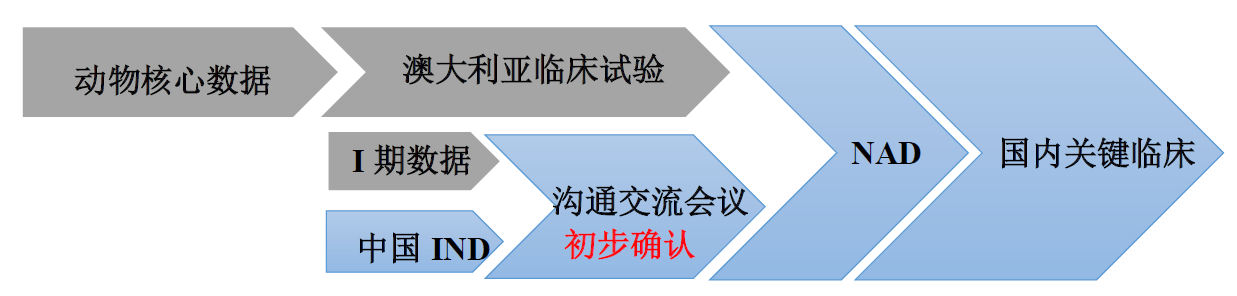
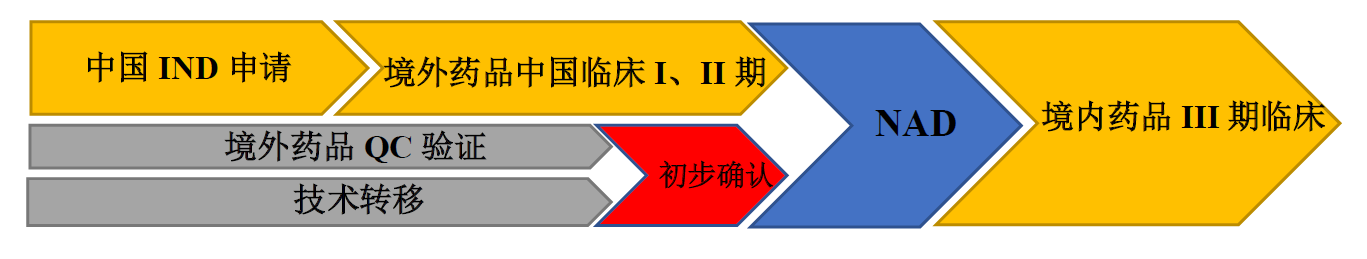
02境外引进品种策略
(1)原料药制剂同时转移
(2)原料药早期无法进行转移,制剂先转移
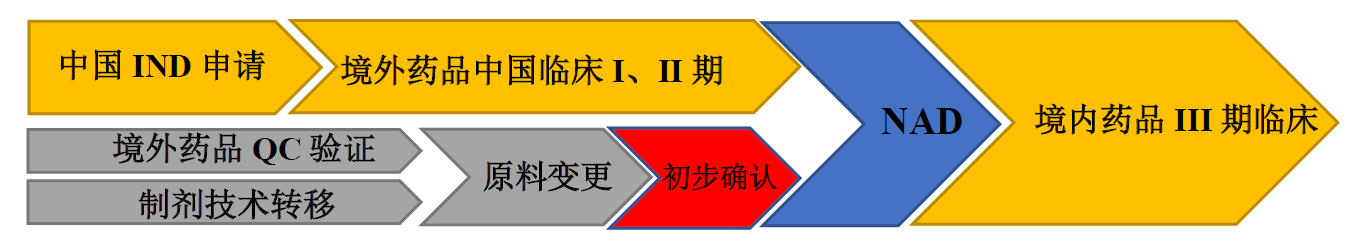

03优先考虑境外上市
关于达石
达石药业(广东)有限公司坐落于伟人孙中山的故里中山·翠亨,是一家致力于提升人类生命质量的药物研发企业,现有国内首个无成瘾镇痛抗体项目和国内领先的抗体工程技术。公司的核心团队成员包括来自礼来、安进、睿智化学等知名药企的海归科学家,其中有中科院“百人计划”和上海市“千人计划”特聘专家。公司已逐步形成从早期药品研发、CMC、临床前研究到临床试验等各个环节有着闭环能力的顶尖新药研发企业,研发及产业化将“孤儿药”潜力或明显竞争优势的抗体药物尽速推向临床应用、造福病患。
公司将秉承孙中山先生“天下为公,永不言弃”的精神,以严谨专业的态度,开发出提升患者生命质量、改善生活品质的新药,征服病痛,回馈社会。

