法规背景
《药品注册管理办法》第八十七条的规定
划重点,12月1日起施行!!!!
程序
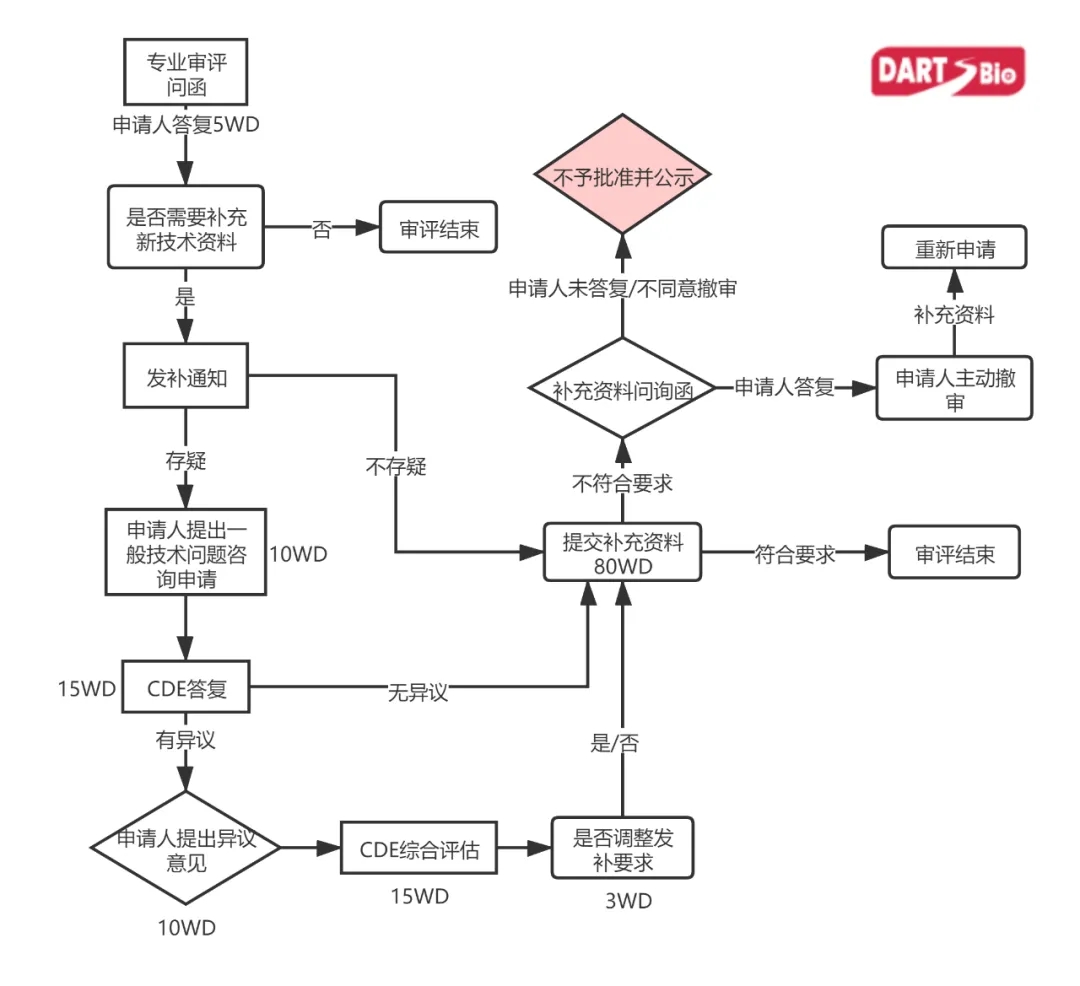
1.发补前:专业审评问询
2.发补期间:正式发补、发补咨询和异议
3.发补后:补充资料问询
一、专业审评问询
药审中心在专业审评期间或综合审评期间,对申报资料有疑义或认为内容存在问题,可向申请人发出“专业审评问询函”,告知申请人以下信息:
1.无需开展研究即可提供的证明性材料;
2.不需要补充新的技术资料,仅需要对原申报资料进行解释说明;
3.审评认为可能需要补充完善的缺陷问题。
申请人应在“专业审评问询函”发出5个工作日内进行解释说明或书面回复。(对于需要书面回复的,申请人应在5个工作日内进行电子提交和寄出与电子版一致的纸质版资料。)
二、正式发布、发补咨询和异议
需要申请人在原申报资料基础上补充新的技术资料的,结合“专业审评问询函”的答复情况,提出一次补充资料要求,以书面方式通知申请人在80个工作日内(暂停审评)补充提交 资料。
如申请人对发补要求有疑问,可在接到书面补充资料通知10个工作日内提出一般性技术问题咨询申请,药审中心在15个工作日内以书面或会议方式完成答复。申请人对答复仍有 异议的,可在收到答复意见之日起10个工作日内提出异议意见,药审中心收到意见之日起15个工作日内进行综合评估是否需要调整发补要求。
三、补充资料问询
药审中心收到全部补充资料后(启动审评,审评时限延长三分之一;适用优先审评审批程序的,审评时限延长四分之一),对未达到发补通知要求或未完全响应发补通知内容的发 送“补充资料问询函”告知申请人。如仍需补充新的技术资料的,则建议申请人主动撤回申请事项并说明理由。
申请人在“补充资料问询函”发出5个工作日内对补充资料进行解释说明或主动撤回申请事项。
申请人未答复“补充资料问询函”或不同意撤审时,药审中心将作出不予批准审评结论并进行公示。
四、发补时限到期提醒和终止审评
补充资料时限到期提醒功能:在补充资料通知要求时限到期前的第5个工作日发出时限到期提醒,提醒申请人按时补充资料。
五、其他
1. 对于超出发补要求和问询函要求范围的资料将不予接收。
2. 申请人在终止审评后如需重新提出注册申请的应提前与药审中心进行沟通交流,并在申报资料中说明资料完善情况和上次审评结论。
六、流程图
结语:
补充资料程序的上台贯彻了“简政放权,放管结合,优化服务”思想,在监督管理方面转化了观念,加强了责任,优化了服务,以创新的方式让监管者主动与企业联系起来,希望在未来看到医药行业的蓬勃发展。
关于达石
达石药业(广东)有限公司坐落于伟人孙中山的故里中山·翠亨,是一家致力于提升人类生命质量的药物研发企业,现有国内首个无成瘾镇痛抗体项目和国内领先的抗体工程技术。公司的核心团队成员包括来自礼来、安进、睿智化学等知名药企的海归科学家,其中有中科院“百人计划”和上海市“千人计划”特聘专家。公司已逐步形成从早期药品研发、CMC、临床前研究到临床试验等各个环节有着闭环能力的顶尖新药研发企业,研发及产业化将“孤儿药”潜力或明显竞争优势的抗体药物尽速推向临床应用、造福病患。
公司将秉承孙中山先生“天下为公,永不言弃”的精神,以严谨专业的态度,开发出提升患者生命质量、改善生活品质的新药,征服病痛,回馈社会。

